Хоріонічний гонадотропін (ХГ, хоріогонадотропін), білковий гормон приматів.
ХГ - глікопротеїн (Мовляв. М. Ок. 38 тис.), Молекула якого складається з двох разл. субодиниць ( 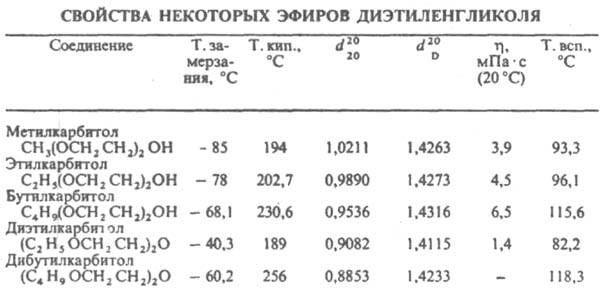 ХГ і
ХГ і 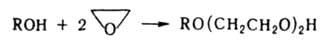 -ХГ), нековалентно пов'язаних один з одним. Молекули ХГ людини і різних видів тварин, володіючи значить. гомологією, збігаються в повному обсязі.
-ХГ), нековалентно пов'язаних один з одним. Молекули ХГ людини і різних видів тварин, володіючи значить. гомологією, збігаються в повному обсязі.
субодиниця 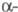 ХГ ідентична
ХГ ідентична 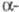 субодиниці лютеїнізуючого гормону, фолікулостимулюючого гормону . а також тиреотропного гормону і включає 92 амінокислотних залишку.
субодиниці лютеїнізуючого гормону, фолікулостимулюючого гормону . а також тиреотропного гормону і включає 92 амінокислотних залишку. 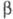 -ХГ, поліпептидний ланцюг якої складається з 145 амінокислотних залишків, специфічна для даного гормону, але проявляє високу ступінь структурної гомології (бл. 80%) з
-ХГ, поліпептидний ланцюг якої складається з 145 амінокислотних залишків, специфічна для даного гормону, але проявляє високу ступінь структурної гомології (бл. 80%) з 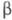 -субодиниці лютеїнізуючого гормону, відрізняючись від останньої подовженням С-кінцевої ділянки поліпептидного ланцюга на 24 амінокислотних залишку.
-субодиниці лютеїнізуючого гормону, відрізняючись від останньої подовженням С-кінцевої ділянки поліпептидного ланцюга на 24 амінокислотних залишку.
На вуглеводну частину, що характеризується значить. гетерогенність, доводиться ок. 30% мол.м. ХГ. До її складу входять сіалова кислота, L-фукоза, D-галактоза, D-маноза, N-ацетилглюкозамин і N-ацетілгалактозамін. 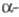 ХГ містить дві олігосахаридні ланцюга, приєднані до поліпептидного ланцюга за допомогою N-гликозидной зв'язку між N-ацетилглюкозамін і амидной групою двох залишків аспарагина .
ХГ містить дві олігосахаридні ланцюга, приєднані до поліпептидного ланцюга за допомогою N-гликозидной зв'язку між N-ацетилглюкозамін і амидной групою двох залишків аспарагина . 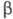 -ХГ містить 6 олігосахаридних ланцюгів, 2 з яких приєднані N-гликозидной зв'язком по залишкам аспарагина . а 4 -О-гликозидной зв'язком між залишками N-ацетілгалактозаміна і групою ОН залишків серина С-кінцевого ділянки поліпептидного ланцюга. Вуглеводні компоненти ХГ необхідні для з'єднання субодиниць, підтримки конформації його молекули, захищають поліпептидні ланцюга субодиниць від розщеплення протеолітичними ферментами. Видалення вуглеводних залишків призводить до значить. зменшення періоду напіввиведення ХГ в організмі.
-ХГ містить 6 олігосахаридних ланцюгів, 2 з яких приєднані N-гликозидной зв'язком по залишкам аспарагина . а 4 -О-гликозидной зв'язком між залишками N-ацетілгалактозаміна і групою ОН залишків серина С-кінцевого ділянки поліпептидного ланцюга. Вуглеводні компоненти ХГ необхідні для з'єднання субодиниць, підтримки конформації його молекули, захищають поліпептидні ланцюга субодиниць від розщеплення протеолітичними ферментами. Видалення вуглеводних залишків призводить до значить. зменшення періоду напіввиведення ХГ в організмі.
Молекула ХГ порівняно легко дисоціює на субодиниці, наприклад при дії сечовини або пропіонової кислоти. Изолир. 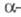 ХГ і
ХГ і 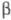 -ХГ позбавлені біол. активності, але можуть рекомбінувати з утворенням біологічно активної молекули ХГ.
-ХГ позбавлені біол. активності, але можуть рекомбінувати з утворенням біологічно активної молекули ХГ.
Специфічний. біол. властивості ХГ обумовлені 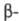 субодиницею. Структурна подібність, наявне між
субодиницею. Структурна подібність, наявне між 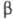 -субодиниці ХГ і лютеїнізуючого гормону, проявляється близькістю їх біол. і іммунологіч. св-в.
-субодиниці ХГ і лютеїнізуючого гормону, проявляється близькістю їх біол. і іммунологіч. св-в.
ХГ виробляється при вагітності клітинами трофобласта (зовнішній шар клітин у зародків ссавців) плаценти. Може також вироблятися деякими пухлинами, родинними по походженню клітинам трофооласта плаценти.
В процесі біосинтезу ХГ спочатку на окремих матричних РНК синтезується поліпептидний ланцюг кожної з субодиниць у вигляді відповідних молекул-попередників з більш високою мовляв. масою. Синтез і приєднання олігосахаридних ланцюгів відбуваються в процесі трансляції субодиниць і після її завершення. Зрілі поліпептидні ланцюга ХГ утворюються шляхом специфічний. протеолітіч. модифікування (укорочення) білків-попередників. Субодиниці об'єднуються в одну молекулу в грубому ендоплазматіч. ретикулуме.
Фізіолого. роль ХГ полягає в підтримці нормального розвитку вагітності. ХГ стимулює продукування жовтим тілом, що утворюється в яєчниках при вагітності, стероїдних гормонів прогестерону та естрогенів . що є необхідною умовою для збереження вагітності. Крім того, ХГ бере участь в регуляції ін. Процесів, пов'язаних з нормальним перебігом вагітності, в т. Ч. Перешкоджає відторгненню зародка в материнському організмі, впливаючи на імунні процеси. При введенні ХГ в організм людини або тварин спостерігається ефект, аналогічний дії лютеїнізуючого гормону . У невагітних жінок ХГ викликає овуляцію в дозрілих фолікулах і освіту жовтих тіл в яєчниках. У чоловіків ХГ стимулює секрецію тестостерону статевими залозами .
Секреція ХГ максимальна в ранньому періоді вагітності. Визначення ХГ в крові або сечі - основа тесту на її наявність.
ХГ виділяють з плаценти людини і тварин. Препарати ХГ для мед. застосування отримують із сечі вагітних жінок. ХГ використовують при зниженні ф-ції статевих залоз у чоловіків і жінок, при безплідді, пізньому статевому розвитку і ін.
Літ .: Димитров Д. Я., хориальной гонадотропін людини, пров. з болт., М., 1979; Фізіологія ендокринної системи, Л., 1979, с. 399; Pierce JG, Parsons Т.F., "Ann. Rev. Biochem.", 1981, v. 50, p. 465-95; Fiddes JC, Talmadge K., "Recent Prog. Horm. Res.", 1984, v. 4, p. 43-78; Lustbader J. [ao], "J. Biol. Chem.", 1987, v. 262, № 29, p. 4204-12.
А. А. Булатов.
XOPHEPA РЕАКЦІЯ (Хорнера-Еммонса р-ція, Уедсворта-Еммонса реакція, Віттіга-Хорнера реакція), отримання олефінів (в т. Ч. Заміщених) взаємодій. альдегідів або кетонів з діалкіловимі ефірами алкілфосфонових кислот (діалкілфосфонатамі) в присутності сильних основ:
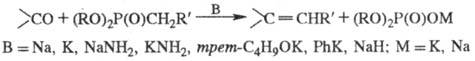
Р-цію проводять в середовищі орг. розчинника (бензол, 1,2-диметоксиетан, ДМФА, ТГФ). Зазвичай спочатку додають фосфонати до суспензії підстави в розчиннику (в результаті утворюється фосфорилюються. карбаніони; див. нижче), потім вводять в реакцію карбонильное з'єднання. Зазвичай не вдається ввести в X. р. просторово утруднені кетони навіть при дуже сильному нагріванні суміші. виходи олефінів 60-90%. Осн. побічні продукти - смоли, конденсується. фосфонати.
Показано, що на першій стадії X. р. утворюється фосфорилюються. карбаніони  Вважається, що до нього приєднується карбонильное соед. і реалізується багатостадійний механізм, аналогічний механізму Віттіга реакції:
Вважається, що до нього приєднується карбонильное соед. і реалізується багатостадійний механізм, аналогічний механізму Віттіга реакції:
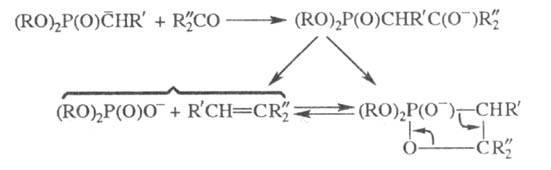
У мн. випадках утворюються на першій стадії р-ції карбаніони відрізняються більшою реакц. здатністю по відношенню до карбонільним соед., ніж реактиви Віттіга (фосфіналкілени).
Фосфонати з активир. групою СН2 в 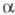 -положенні м. б. перед проведенням X. р. модифіковані шляхом введення в це положення атомів галогенів, алкильной групи і т. п., що дозволяє синтезувати олефіни складної будови, наприклад:
-положенні м. б. перед проведенням X. р. модифіковані шляхом введення в це положення атомів галогенів, алкильной групи і т. п., що дозволяє синтезувати олефіни складної будови, наприклад:
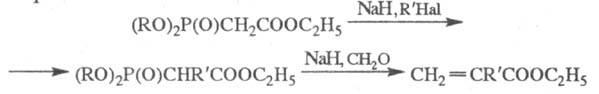
Кетени в умовах X. р. дають алени,  дикетони - пов'язані дієни, оксиди олефінів - похідні циклопропану.
дикетони - пов'язані дієни, оксиди олефінів - похідні циклопропану.
X. р. використовують в лаб. практиці. Відкрита Л. Хорнер з співробітниками в 1958.
Літ .: Домбровський А. В., Домбровський В. А., «Успіхи хімії», 1966, т. 35, ст. 10, с. 1771-87; Homer L. (ua], "Chem. Ber.", 1958, Bd 91, № 1, S. 61-63; Wads worth WS, в кн .: Organic reactions, v. 25, NY-L., 1977, p. 73-253; Stec WJ, "Acc. Chem. Res.", 1983, v. 16, № 11, p. 411-17.
Г. І. Дрозд.





